In Inghilterra lo scienziato John Bell, che ha guidato il team AstraZeneca-Università di Oxford nello studio per il loro vaccino, ha affermato come non sia ancora chiaro se gli attuali vaccini possano essere efficaci contro la variante sudafricana del coronavirus. Anche il segretario inglese alla Sanità si è detto molto preoccupato , poiché pure in Gran Bretagna la campagna vaccinale ha preso il via.
Anche in Italia, come si diceva, la campagna di vaccinazione è iniziata, con le dosi del vaccino Comirnaty della Pfizer-Biontech. Nella relazione sul prodotto fornita da EMA, European Medicines Agency, sono elencate anche le informazioni che ancora mancano e gli effetti collaterali.
Nella giornata del 7 gennaio Aifa ha autorizzato anche il vaccino Moderna e lo ha annunciato con un comunicato stampa in cui si sottolineano anche alcune differenza rispetto al Comirnaty.
La relazione EMA contenente le informazioni sul vaccino Covid, Comirnaty, è disponibile QUI
Dalla relazione:
«Si tratta di un vaccino a mRNA, modificato a livello dei nucleosidi».
· «La sicurezza e l’efficacia di Comirnaty nei bambini e negli adolescenti di età inferiore a 16 anni non sono state ancora stabilite. I dati disponibili sono limitati».
· «Sono stati segnalati casi di anafilassi. Devono essere sempre immediatamente disponibili trattamento e assistenza medica adeguati nel caso di comparsa di una reazione anafilattica in seguito alla somministrazione del vaccino. Dopo la vaccinazione si raccomanda un attento monitoraggio per almeno 15 minuti. Non somministrare la seconda dose del vaccino a soggetti che abbiano manifestato anafilassi alla prima dose di Comirnaty».
· «L'efficacia, la sicurezza e l’immunogenicità del vaccino non sono state valutate nei soggetti immunocompromessi, compresi quelli in terapia immunosoppressiva».
· «La durata della protezione offerta dal vaccino non è nota; sono tuttora in corso studi clinici volti a stabilirla».
· «Interazioni con altri medicinali ed altre forme d’interazione - Non sono stati effettuati studi d’interazione. La somministrazione concomitante di Comirnaty con altri vaccini non è stata studiata».
· «Non sono stati condotti studi di genotossicità o sul potenziale cancerogeno».
Viene illustrata anche la procedura per trattare il vaccino che risulta complessa e che richiede una "catena di conservazione" e di preparazione assai efficace ed efficiente.
«Periodo di validità - Flaconcino chiuso: 6 mesi a una temperatura compresa tra -90 °C e -60 °C. Una volta estratto dal congelatore, il vaccino chiuso può essere conservato prima dell’uso fino a 5 giorni a una temperatura compresa tra 2 e 8 °C, e fino a 2 ore a una temperatura non superiore a 30 °C. Una volta scongelato, il vaccino non deve essere ricongelato. Una volta estratti dal congelatore (<-60 °C), i vassoi di flaconcini a coperchio chiuso contenenti 195 flaconcini possono rimanere a temperatura ambiente (<25 °C) per un massimo di 5 minuti per consentire il trasferimento fra ambienti a temperatura ultra-bassa. Dopo essere stati nuovamente trasferiti in congelatore in seguito all’esposizione a temperatura ambiente, i vassoi di flaconcini devono rimanere in congelatore per almeno 2 ore prima che sia possibile estrarli nuovamente».
«Medicinale diluito - La stabilità chimica e fisica in uso è stata dimostrata per 6 ore a una temperatura compresa tra 2 e 30 °C in seguito a diluizione con soluzione iniettabile di sodio cloruro da 9 mg/mL (0,9%). Da un punto di vista microbiologico, il prodotto deve essere utilizzato immediatamente. Se non viene utilizzato immediatamente, i tempi e le condizioni di conservazione prima del suo impiego sono di responsabilità dell’operatore».
«Precauzioni particolari per la conservazione - Conservare in congelatore a una temperatura compresa tra -90 °C e -60 °C. Conservare nella confezione originale per proteggere il medicinale dalla luce. Durante la conservazione, ridurre al minimo l’esposizione alla luce ambientale, ed evitare l’esposizione alla luce solare diretta e alla luce ultravioletta. Dopo lo scongelamento, i flaconcini possono essere maneggiati in condizioni di luce ambientale.
Quando si è pronti a scongelare o utilizzare il vaccino:
•Una volta estratti dal congelatore (<-60 °C), i vassoi di flaconcini a coperchio aperto o i vassoi di flaconcini contenenti meno di 195 flaconcini possono rimanere a temperatura ambiente (<25 °C) per un massimo di 3 minuti per consentire l’estrazione dei flaconcini o il trasferimento fra ambienti a temperatura ultra-bassa.
•Quando un flaconcino viene estratto dal vassoio, deve essere scongelato per l’uso.
•Dopo essere stati nuovamente trasferiti in congelatore in seguito all’esposizione a temperatura ambiente, i vassoi di flaconcini devono rimanere in congelatore per almeno 2 ore prima che sia possibile estrarli nuovamente».
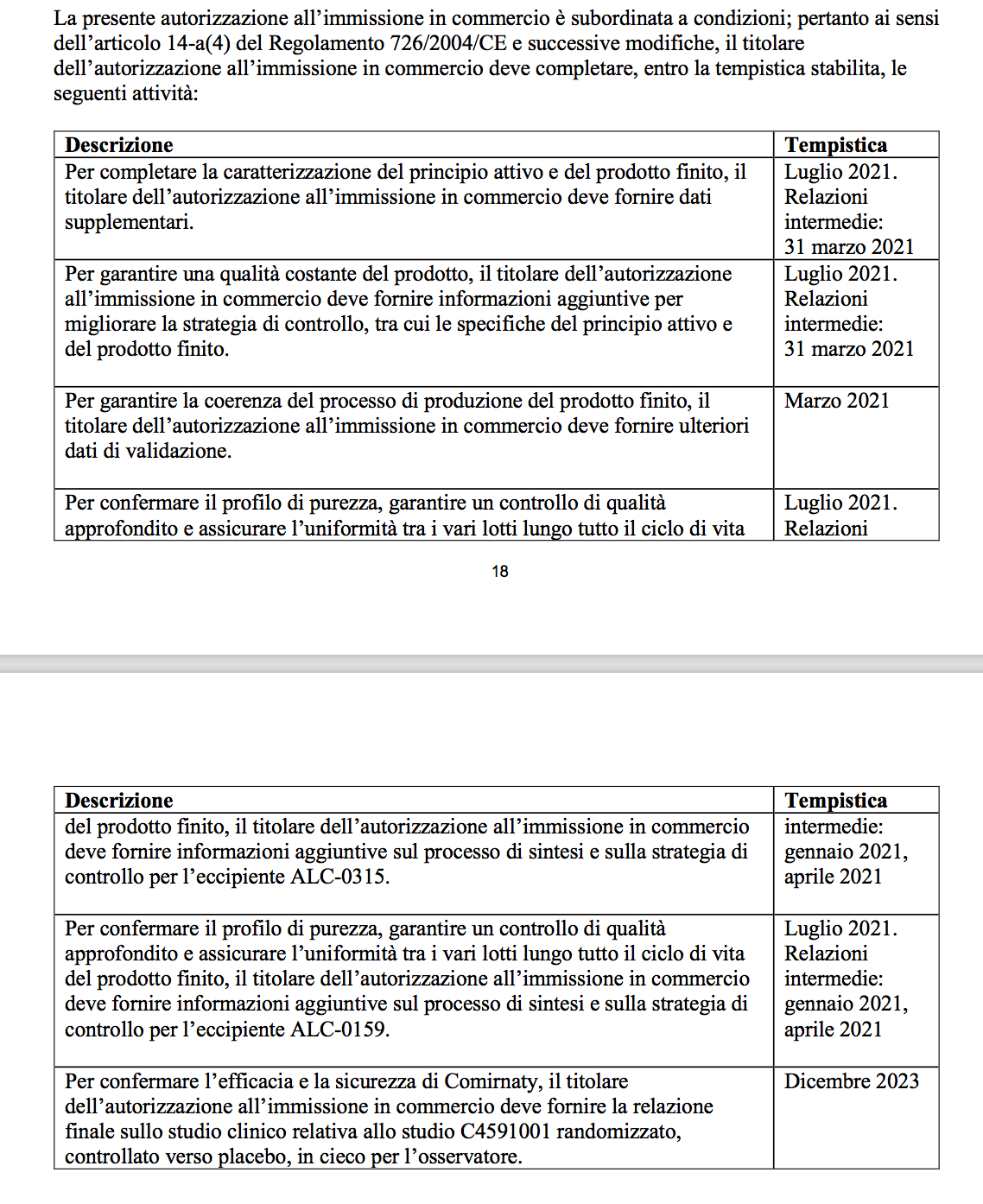
Qui di seguito la tabella con le tempistiche con cui il produttore dovrà fornire gli studi che ancora non ci sono.
Sempre EMA specifica che «l’impatto della vaccinazione con Comirnaty sulla diffusione del virus SARS-CoV-2 nella comunità non è ancora noto. Non si conosce ancora fino a che punto i soggetti vaccinati possano ancora essere portatori del virus e in grado di diffonderlo».
«Al momento non si conosce la durata della protezione fornita da Comirnaty. Le persone vaccinate nell’ambito della sperimentazione clinica continueranno a essere monitorate per 2 anni per raccogliere maggiori informazioni sulla durata della protezione».
«Poiché Comirnaty ha ricevuto un’autorizzazione all’immissione in commercio subordinata a condizioni, la ditta che lo commercializza continuerà a fornire i risultati della sperimentazione principale, che proseguirà per 2 anni. Questa sperimentazione e altri studi forniranno informazioni sulla durata della protezione, sulla capacità del vaccino di prevenire la forma grave di COVID-19, sulla misura in cui il vaccino protegge le persone immunocompromesse, i bambini e le donne in gravidanza, e sulla capacità di prevenire i casi asintomatici. Inoltre, studi indipendenti sui vaccini COVID-19, coordinati dalle autorità dell’UE, forniranno informazioni aggiuntive sulla sicurezza a lungo termine del vaccino e sui relativi benefici per la popolazione in generale. La ditta condurrà inoltre studi per fornire ulteriori garanzie sulla qualità farmaceutica del vaccino, man mano che la produzione continuerà ad aumentare».
Sulla rivista Science , Jop De Vrieze, giornalista scientifico olandese, ha affermato che le reazioni allergiche che si sono manifestate dopo la somministrazione del vaccino Pfizer potrebbero essere dovute alla presenza di una sostanza chiamata PEG, polietileglicole o glicole polietilenico. Nell’articolo De Vrieze afferma che il National Institute of Allergy and Infectious Diseases americano e la Food and Drug Administration stanno valutando la cosa.
QUI il link al foglietto illustrativo di Comirnaty
Sul sito di AIFA, l’Agenzia Italiana de Farmaco, nelle FAQ sul vaccino, al punto 9 viene anche in questo caso dichiarato che «La durata della protezione non è ancora definita con certezza perché il periodo di osservazione è stato necessariamente di pochi mesi, ma le conoscenze sugli altri tipi di coronavirus indicano che la protezione dovrebbe essere di almeno 9-12 mesi».
Al punto 11 si legge: «(…) è necessario più tempo per ottenere dati significativi per dimostrare se i vaccinati si possono infettare in modo asintomatico e contagiare altre persone. Sebbene sia plausibile che la vaccinazione protegga dall’infezione, i vaccinati e le persone che sono in contatto con loro devono continuare ad adottare le misure di protezione anti COVID-19».
Al punto 14: «(…) Nei Paesi dove è già stata avviata la somministrazione di massa del vaccino sono cominciate anche le segnalazioni delle reazioni avverse, da quelle meno gravi a quelle più significative, comprese le reazioni allergiche. Tutti i Paesi che avviano la somministrazione del vaccino estesa a tutta la popolazione raccoglieranno e valuteranno ogni segnalazione pervenuta al sistema di farmaco vigilanza delle reazioni averse al vaccino, così da poter definire con sempre maggior precisione il tipo di profilo di rischio legato alla vaccinazione».
Al punto 31: «Anche se l’efficacia del vaccino COVID-19 mRNA BNT162b2 è molto alta (oltre il 90%) vi sarà sempre una porzione di vaccinati che non svilupperà la difesa immunitaria, inoltre, ancora non sappiamo in maniera definitiva se la vaccinazione impedisce solo la manifestazione della malattia o anche il trasmettersi dell’infezione. Ecco perché essere vaccinati non conferisce un “certificato di libertà” ma occorre continuare ad adottare comportamenti corretti e misure di contenimento del rischio di infezione».
Di recente, sulla questione vaccini Covid ha preso posizione la Rete Sostenibilità e Salute chiedendo che non sia previsto l’obbligo di legge e che sia impostato e condotto uno studio clinico per confrontare persone non vaccinate e vaccinate per il Covid.